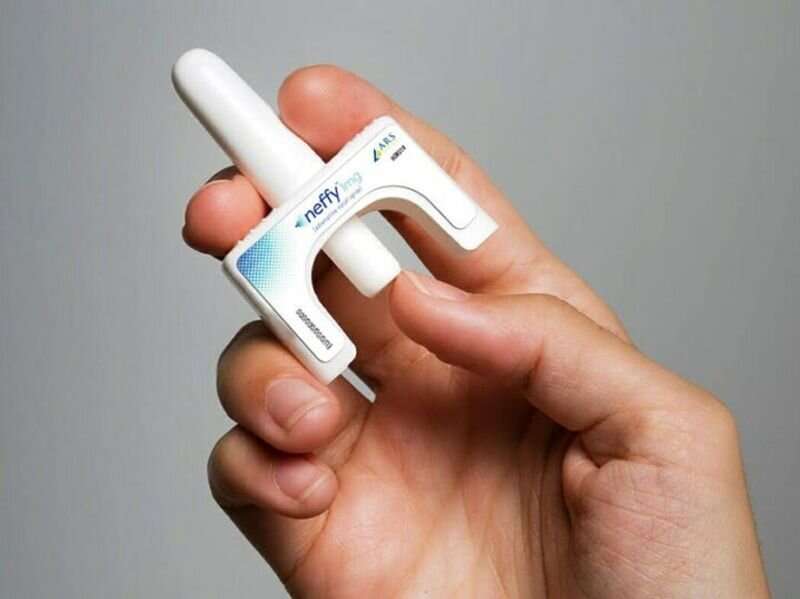
Asesores externos de la Administración de Drogas y Alimentos de EE. UU. votaron el jueves para recomendar la aprobación de Neffy, el primer aerosol nasal de epinefrina para reacciones alérgicas graves.
Aunque la mayoría de los miembros del Comité Asesor de Medicamentos para Alergias Pulmonares apoyaron el aerosol para adultos (16:6) y niños (17:5), persisten preguntas clave sobre si se necesitan más datos de su fabricante, ARS Pharmaceuticals, informó CBS News.
Pero Richard Lowenthal, cofundador, presidente y director ejecutivo de ARS, dijo en un declaración de la empresa después de la votación que, «Creemos que nuestros datos clínicos de más de 600 personas demuestran que la tecnología de aerosol nasal que mejora la absorción de Neffy es comparable a los productos inyectables en la administración de epinefrina que puede salvar vidas, pero con ventajas únicas de ser pequeño, sin aguja y de tamaño conveniente. »
Lowenthal agregó: «Estamos comprometidos a facilitar que los pacientes y los cuidadores lleven y administren epinefrina sin la ansiedad y la vacilación asociadas con el uso de un dispositivo con aguja».
Neffy administra una dosis de 2 miligramos de epinefrina. En lugar de grandes ensayos clínicos, la compañía farmacéutica comparó su producto con productos de epinefrina inyectable ya aprobados, como el EpiPen. Mostró que los resultados para Neffy no eran ni sustancialmente más altos ni más bajos que los de la epinefrina inyectable.
«Los pacientes necesitan opciones, con diferentes métodos de administración, para facilitar el uso real de la epinefrina en un evento de emergencia», dijo en el comunicado de prensa de la compañía el Dr. Carlos Camargo, profesor de medicina de emergencia de la Facultad de medicina de Harvard en Boston.
«Los efectos de la epinefrina sobre la presión arterial y la frecuencia cardíaca son sustitutos de la eficacia y son importantes para determinar si alguien está respondiendo al tratamiento. Con Neffy, la presión arterial y la frecuencia cardíaca son comparables con EpiPen con una sola dosis y con una segunda dosis de Neffy, los aumentos en la presión arterial sistólica fueron estadísticamente más altos, incluso mejores que los revelados en los datos disponibles de EpiPen, que es crucial para los pacientes que requieren una segunda dosis por una reacción alérgica grave», agregó Camargo.
La epinefrina se ha utilizado desde 1901 mediante inyección. Nunca pasó por el mismo proceso de aprobación que los medicamentos ahora porque estaba en el mercado antes de que existiera la FDA, informó CBS News.
Eso significa que la FDA no tiene muchos datos que pueda usar para comparar la efectividad de Neffy para salvar a los pacientes que tienen una reacción alérgica grave.
Como resultado, no está del todo claro si el aerosol nasal funcionará tan bien como la epinefrina inyectable.
«Realmente odiaría saber, sin mejores datos clínicos, que recomendamos la aprobación de un producto sobre la base de datos sustitutos que son inconsistentes y algo confusos y, en última instancia, debido a eso, los pacientes se ven perjudicados», dijo el miembro del comité, el Dr. Lewis Nelson. dijo, informó CBS News.
Pero tampoco es seguro si más investigación realmente ofrecería información adicional.
«¿Qué más podemos razonablemente legítimamente esperar?» dijo el miembro del comité Dr. Leonard Bacharier. «Y si eso resultara exactamente como lo queríamos, ¿tendríamos mucha más confianza que donde estamos sentados ahora? Simplemente no estoy seguro de eso».
Se espera que la FDA tome una decisión sobre si aprobar o no a Neffy a mediados de este año. La compañía ha dicho que podría comenzar a vender el aerosol a fines de 2023. El medicamento está diseñado para funcionar en pacientes que pesan alrededor de 66 libras o más.
La investigación de la compañía incluyó una encuesta que mostró que las personas probablemente usarían el aerosol 18 minutos antes que un medicamento inyectable, y que hasta un 35 % más de personas lo llevarían consigo.
“Si no lo tienen con ellos, es un punto discutible. No entregan, no tienen medicamentos, van al hospital”, dijo Lowenthal al comité, informó CBS News.
Más información:
El Colegio Estadounidense de Alergias, Asma e Inmunología tiene más información sobre anafilaxia.
Derechos de autor © 2023 SaludDía. Reservados todos los derechos.
Citación: El panel de la FDA recomienda la aprobación del primer aerosol nasal para combatir los ataques de alergia graves (12 de mayo de 2023) consultado el 14 de mayo de 2023 en https://medicalxpress.com/news/2023-05-fda-panel-nasal-spray-combat.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin el permiso por escrito. El contenido se proporciona únicamente con fines informativos.


